トップページ
 研究活動
研究活動
 研究成果 ピックアップ
研究成果 ピックアップ
 「富岳」を使い新型コロナウイルスの侵入のメカニズムの解明に貢献 ~「富岳」による新型コロナウイルス対策その4
「富岳」を使い新型コロナウイルスの侵入のメカニズムの解明に貢献 ~「富岳」による新型コロナウイルス対策その4
「富岳」を使い新型コロナウイルスの侵入のメカニズムの解明に貢献 ~「富岳」による新型コロナウイルス対策その4
「富岳」を使い新型コロナウイルスの侵入のメカニズムの解明に貢献 ~「富岳」による新型コロナウイルス対策その4
粒子系生物物理研究チーム/理研 生命機能科学研究センター 分子機能シミュレーション研究チーム チームリーダー 杉田有治
今回は、スーパーコンピュータ「富岳」を使った「新型コロナウイルス表面のタンパク質の動的構造予測」を紹介します。これは、新型コロナウイルス表面のスパイクタンパク質の立体構造が変化する過程をシミュレーションし、ヒトの細胞表面とどのように結合するかを予測しようというものです。それにより、有効なワクチンや薬剤の開発に役立つことが期待されます。
(代表者:理化学研究所 計算科学研究センター 粒子系生物物理研究チーム / 同 生命機能科学研究センター 分子機能シミュレーション研究チーム チームリーダー 杉田有治)
新型コロナウイルスのスパイクタンパク質の立体構造の変化を可視化
新型コロナウイルスが増殖するためには、我々の細胞内に侵入する必要があります。これまでの研究から、新型コロナウイルスの表面はスパイクタンパク質と呼ばれる複数の突起で覆われており、このスパイクタンパク質が我々の細胞の表面にあるACE2受容体というレセプタータンパク質と結合することで、我々の細胞内に侵入することがわかっています。
この仕組みは「鍵と鍵穴」の関係にたとえられます。新型コロナウイルスは、スパイクタンパク質という不正な合鍵を使ってレセプタータンパク質という鍵穴を開け、細胞内に侵入してくるというわけです。新型コロナウイルスの侵入を阻止するようなワクチンや薬剤を開発するには、スパイクタンパク質とレセプタータンパク質の立体構造を明らかにし、結合のメカニズムを詳細に理解する必要があります。
実はスパイクタンパク質とレセプタータンパク質の立体構造は、感染が広がり始めた早い段階から、クライオ電子顕微鏡(低温電子顕微鏡)による観測により判明していました。しかし、タンパク質は絶えず動いており、立体構造は変化し続けているため、どのようなタイミングで両者が結合するのか、またその結合状態はよくわかっていませんでした。
そこで、本研究チームは「富岳」上で、超並列分子動力学計算 ※1 ソフトウェア「GENESIS」 ※2 を使い、スパイクタンパク質の立体構造の変化の過程をシミュレーションすることで、実験や観測では難しい、結合のメカニズムの解明に取り組みました。
- 1 分子動力学計算:粒子間の相互作用をクーロンの法則などの物理法則に基づいて計算し、ニュートンの運動方程式を解くことで、分子の動きをシミュレーションする手法。ピコ(1兆分の1)~マイクロ(100万分の1)秒の時間変化を原子レベルの解像度で再現できる。
- 2「GENESIS」:巨大な生体分子システムをシミュレーションするために、本研究チームがスーパーコンピュータ「京」向けに開発した分子動力学計算ソフトウェア。2015年からフリーソフトウェアとして一般に公開。生体分子の運動を1分子から原子1億個を超える細胞レベルまで幅広い空間スケールで超並列計算できるのが特徴。「京」から「富岳」への移行後は、「富岳」に対して「GENESIS」を最適化することで、全ノードを用いた場合、「京」に比べて125倍以上の演算速度を実現することに成功している。
「富岳」により、通常1年以上はかかる計算を3週間程度で完了
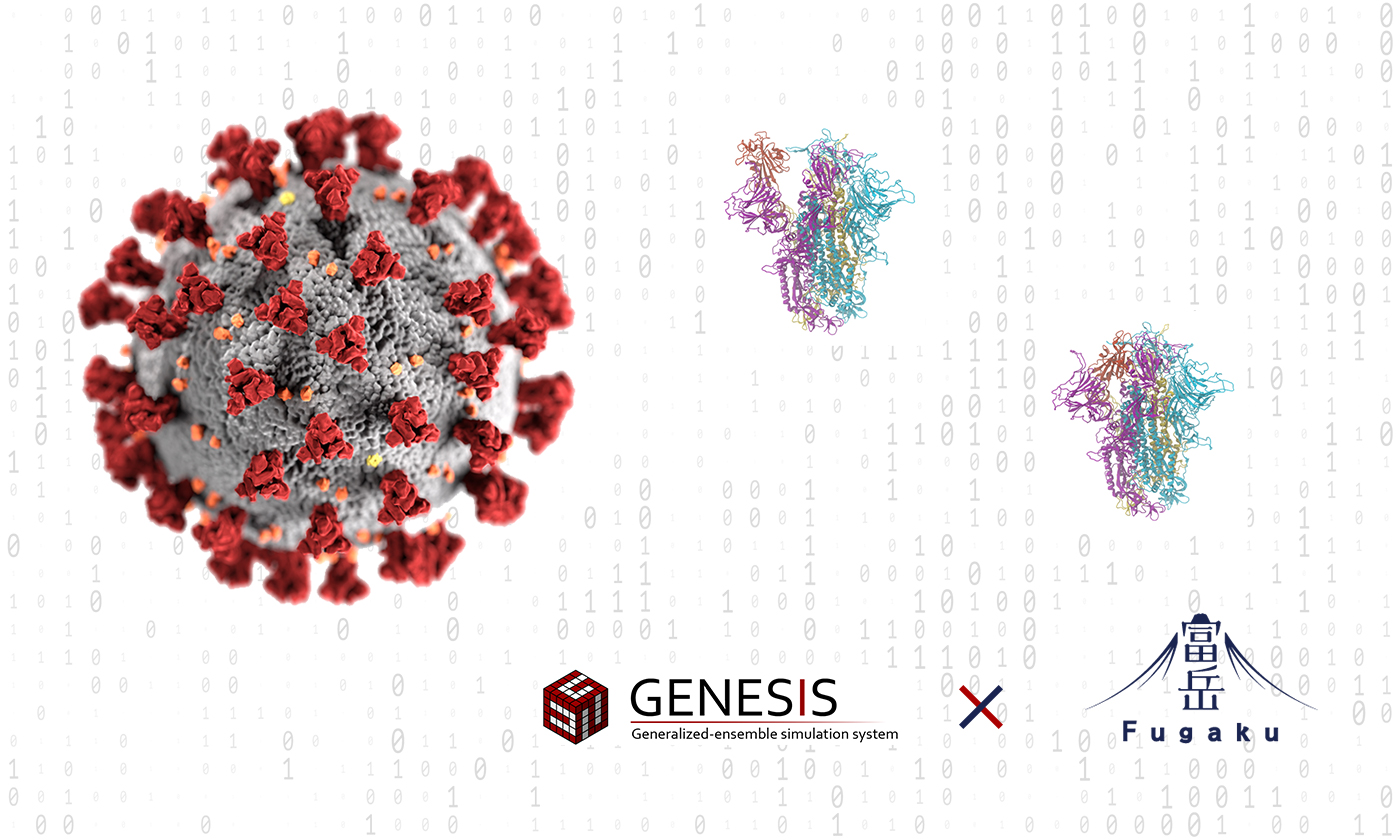
新型コロナウイルスのスパイクタンパク質は、図1のように、3つの同じペプチド鎖(ペプチド鎖とは、アミノ酸がペプチド結合により短い鎖状につながった化合物のこと)からなる三量体で、ヒトの細胞表面のACE2受容体と結合する部分である受容体結合ドメイン(RBD:receptor binding domain)には、活性型のUp(以下、Up型)と不活性型のDown(以下、Down型)という少なくとも2つの立体構造が存在することがわかっています。Up型は1つのRBDが飛び出したような形をしており、この状態でACE2受容体と結合します。一方、Down型は3つのRBDが閉じた形をしています。クライオ電子顕微鏡による解析からは、Up型とDown型以外にも複数の立体構造が存在することが示唆されています。
Down型からUp型へ立体構造が変化するまでにはかなりの時間を要するため、従来のスーパーコンピュータでは、計算が完了するまでに1年以上はかかるものと推測されました。それに対し、本研究チームが、「富岳」上で「GENESIS」を用いてシミュレーションしたところ、3週間程度で、Down型からUp型への立体構造の変化の過程を詳細に再現することに世界で初めて成功しました(図2)。
成功のポイントは3点あります。1つ目は「富岳」の計算性能の高さ、2つ目は、コデザイン※3の思想に基づき、「富岳」の開発段階から「GENESIS」を最適化していたこと、そして、3つ目は「gREST法」と呼ばれるアルゴリズムの搭載です。
「gREST法」とは、巨大な分子システムのうちの一部分だけを温度変化させることにより、構造変化を加速させることができるという手法(図3)で、「GENESIS」にはこの「gREST法」が搭載されています。今回のスパイクタンパク質のシミュレーションでは、特にRBDの部分の温度だけを高めることで、この部分の立体構造の変化を加速することができ、Down型からUp型への立体構造の変化の過程をとらえることに成功しました。
- 3 コデザイン:計算機科学的な開発(ハードウェアなど)とアプリケーション開発を協調しながら進めるという方法で、「富岳」の開発で重点的に取り組んだ。「GENESIS」は9つのターゲットアプリケーションの1つに選ばれ、早期から「富岳」向けの最適化が行われた。
-
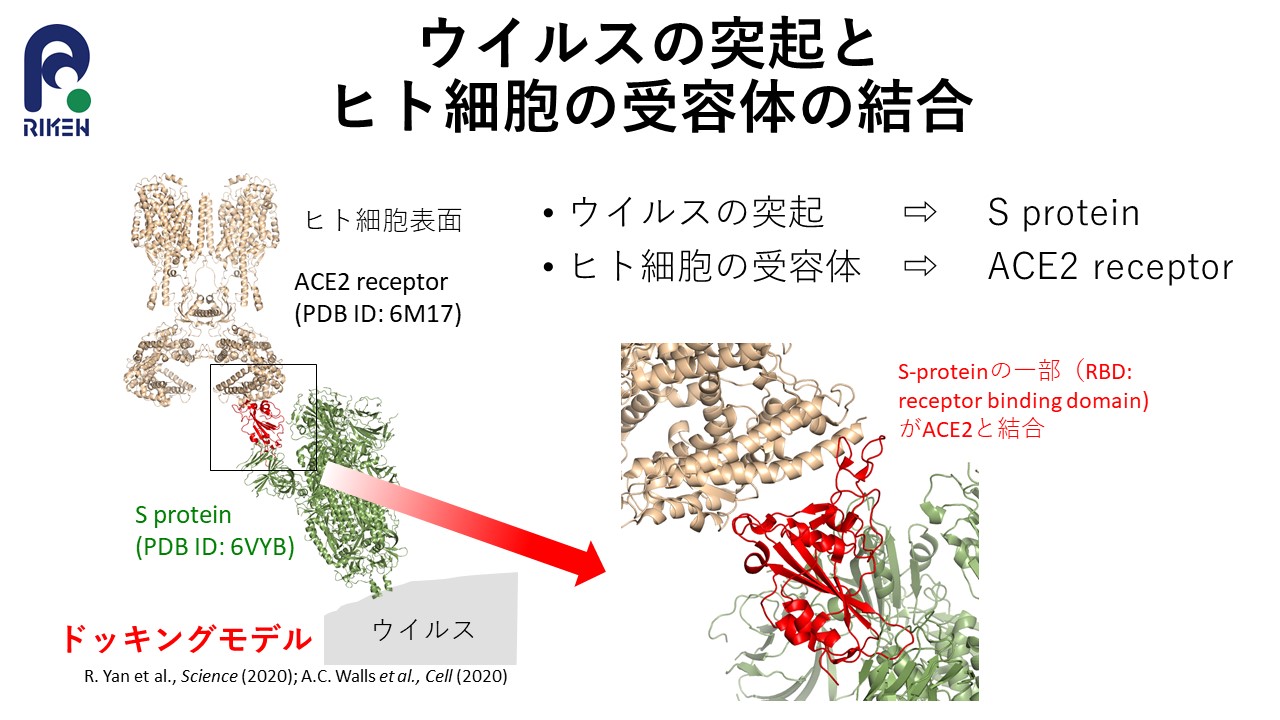
図1:新型コロナウイルスのスパイクタンパク質(S protein)
赤い部分の受容体結合ドメイン(RBD)がヒトの細胞表面のACE2受容体(ACE2 receptor)と結合することで我々の細胞内に侵入する。(出典:杉田有治(理化学研究所))
-
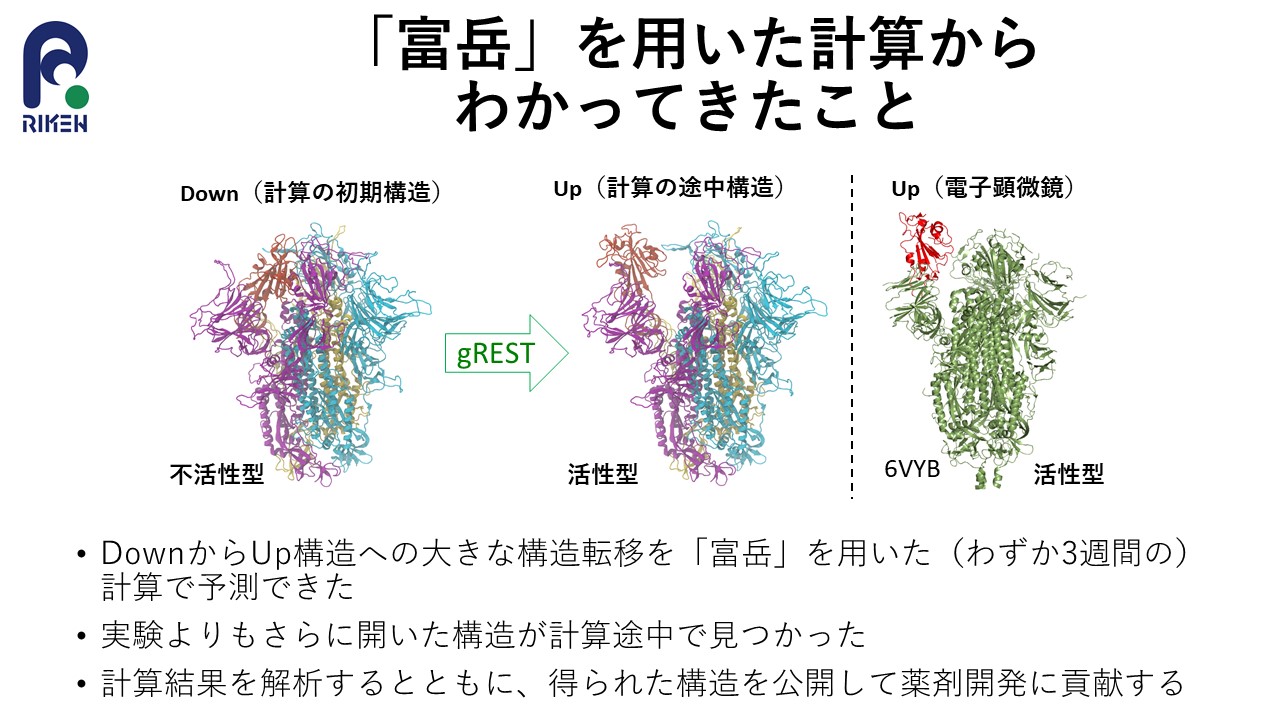
図2:スパイクタンパク質のシミュレーション
「富岳」上で「gREST法」を搭載した「GENESIS」を用い、水分子も含め70万原子以上を使って、スパイクタンパク質をシミュレーション。その結果、Down型からUp型への立体構造の変化の過程を詳細に再現することに成功。クライオ電子顕微鏡で得られたUp型の立体構造(右)とシミュレーションの過程で得られたUp型(Open型)の立体構造(中央)がよく似ていることがわかる。(出典:杉田有治(理化学研究所))
-
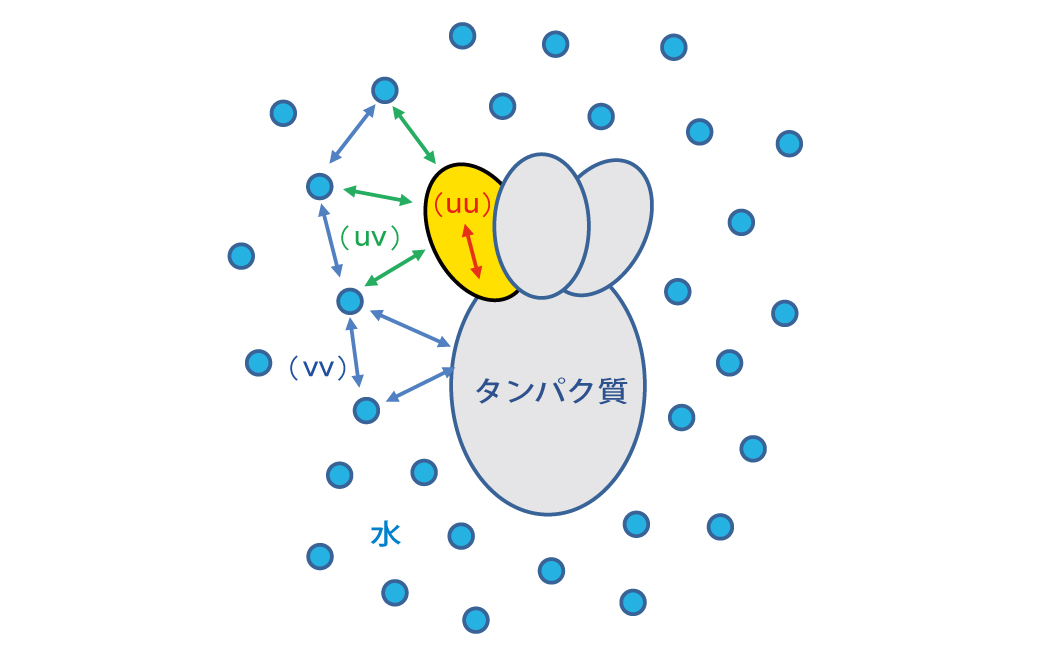
図3:「gREST法」の概念図
巨大な分子システムのうちの一部分だけを温度変化させることでその部分の構造変化を加速させることができる。それにより計算時間を大幅に短縮しながら、ほしいシミュレーション結果を得ることができる。(出典:杉田有治、「現代化学」2020年11月号、p32より)
スパイクタンパク質の表面を覆う糖鎖の役割を解明
また、スパイクタンパク質の表面は、無数の糖鎖(糖鎖とは、グルコースやグルコサミンなどの糖が鎖状につながった化合物のこと)によって覆われていることが知られています。スパイクタンパク質にヒトの抗体が結合することで、我々は新型コロナウイルスへの感染を抑えることができます。それに対し、新型コロナウイルスはスパイクタンパク質の表面を無数の糖鎖で覆うことで、ヒトの免疫システムから逃れようとしていると考えられています。有効で安全なワクチンを開発するには、スパイクタンパク質における糖鎖の働きを理解することが重要です。そこで、本研究チームは糖鎖を含むスパイクタンパク質のシミュレーションも実施しました。
その結果、スパイクタンパク質はUp型になると、立体構造が不安定になることが予想されますが、柔軟性の高い複数の糖鎖が表面を覆っていることで、立体構造の安定化に寄与しているということがわかりました。
加えて、そもそも外部からエネルギーを得てもいないのに、なぜ立体構造がDown型からUp型に変化するのかが大きな謎だったのですが、シミュレーション結果から、Down型は一見安定性が高そうに見えるものの、実はもともと電荷の偏りがあり、比較的不安定な立体構造であるため、Up型に容易に変化しやすいということもわかりました。
スパイクタンパク質において糖鎖がどのような役割を果たしているかを解明するため、世界中で、Down型もしくはUp型から出発したシミュレーションが実施されていますが、本研究チームのように、表面に糖鎖が覆った状態でDown型から出発し、Up型まで立体構造を変化させる過程を詳細にシミュレーションできた例は他にありません。
これらのシミュレーション結果からは、Down型の構造をより安定化させるような薬剤を開発すれば、新型コロナウイルスの感染力が低下することなどがわかりました。今後は、スパイクタンパク質に抗体が付いた場合に、その立体構造がどのように変化するかについてもシミュレーションすることで、ワクチン開発にも役立てていきたいと考えています。
「富岳」の計算性能の高さで生命科学の発展に貢献
現在、本研究チームでは、喫緊の課題として新型コロナウイルス対策に向けたシミュレーションに取り組んでいますが、「富岳」を使った元来のプロジェクトとしては3つの課題に取り組んでいます。
1つ目は「GENESIS」を使った膜タンパク質の研究です。膜タンパク質の中でも特に輸送タンパク質はさまざまな物質を細胞内に取り込むタンパク質として生物の成長に必須です。そのため、そのメカニズムの解明は生命科学の発展において極めて重要です。
2つ目は、タンパク質と薬剤との結合に関するメカニズムの解明です。
そして、3つ目は、細胞スケールのシミュレーションです。細胞内には多くのタンパク質が存在しており、タンパク質の濃厚溶液のような状態になっています。そのような状態に置かれたタンパク質の機能を、シミュレーションにより解析したいと考えています。そのため、原子一つ一つを粒子として扱う「全原子シミュレーション」に対し、現在、原子を複数個まとめた粒子を用いた「粗視化シミュレーション」の開発に取り組んでいます。
これらの3つの課題はいずれも計算量が膨大であり、従来のスーパーコンピュータでは十分な計算ができませんでした。それに対し、「富岳」を使うことで計算時間を大幅に短縮できることから、大きな成果が期待されます。今後も本研究チームは「富岳」と「GENESIS」を駆使することで生命科学の発展に貢献していきます。
関連リンク
(2021年7月14日)
