トップページ
 研究活動
研究活動
 研究成果 ピックアップ
研究成果 ピックアップ
 「富岳」を使ったシミュレーションとAIの融合による次世代IT創薬への取り組み
「富岳」を使ったシミュレーションとAIの融合による次世代IT創薬への取り組み
「富岳」を使ったシミュレーションとAIの融合による次世代IT創薬への取り組み
「富岳」を使ったシミュレーションとAIの融合による次世代IT創薬への取り組み
HPC/AI駆動型医薬プラットフォーム部門 分子デザイン計算知能ユニット ユニットリーダー 池口満徳

理化学研究所計算科学研究センター(R-CCS)では、2021年4月に新たにHPC/AI駆動型医薬プラットフォーム部門が加わりました。本記事では、この部門のうち理研横浜キャンパスを拠点とする「分子デザイン計算知能ユニット」(ユニットリーダー 池口満徳)について、「富岳」を使ったシミュレーションとAIの融合による次世代IT創薬への取り組みを紹介します。この研究により、創薬においてこれまで時間がかかっていた開発プロセスが効率化され、飛躍的に短縮化されることが期待されます。
(代表者:理化学研究所 計算科学研究センター HPC/AI駆動型医薬プラットフォーム部門 分子デザイン計算知能ユニット ユニットリーダー 池口満徳)
「富岳」の成果創出加速プログラムの下、次世代IT創薬を加速
HPC/AI駆動型医薬プラットフォーム部門では、インシリコ創薬に取り組んでいます。インシリコ創薬とは、計算科学によりコンピュータの中で薬を開発する創薬手法です。
このHPC/AI駆動型医薬プラットフォーム部門において現在、「富岳」の成果創出加速プログラム「プレシジョンメディスンを加速する創薬ビッグデータの統合システム推進」の下、「富岳」を使った分子動力学シミュレーション(MD法)とAIの融合による次世代IT創薬(インシリコ創薬)を進めているのが、分子デザイン計算知能ユニットでユニットリーダーを務める池口満徳の研究室です。
池口ユニットリーダーは2016年に発足した「医科学メディカルイノベーションハブ推進プログラム(MIH)」にも参画しており、MIHにある10のワーキンググループのうち、医薬プロセス最適化プラットフォーム推進グループの分子設計インテリジェンスユニットのユニットリーダーも務めてきました。
長年取り組んできた「分子動力学シミュレーション(MD法)」
歴史的に、低分子化合物が医薬品としてよく用いられてきました。タンパク質の立体構造には凹みがあり、その凹みにはまるように、低分子化合物を設計するというやり方です。たとえば、低分子化合物でできた医薬品は、がん細胞の増殖に関与しているタンパク質の凹みにはまって結合することで、がん細胞の増殖を抑制することができます。このようなタンパク質の立体構造をベースとした創薬を、ストラクチャーベースド・ドラッグデザイン(SBDD)といいます。現在多くの製薬企業がSBDDを導入しています。
とはいえ、疾病に関連するタンパク質の立体構造を基に新薬を開発するのは容易なことではありません。世の中には数億種類もの医薬品の候補となる低分子化合物が存在し、そこから医薬品を設計するための元の化合物を見つけ出すのも大変です。そこで、現在、しばしば実施されているのがインシリコスクリーニングです。これはコンピュータを使って、疾病に関連するタンパク質に結合しやすい化合物をスクリーニングしようというものです。インシリコスクリーニングにより候補化合物を絞り込んだ上で、実際に実験することで、創薬プロセスの大幅な効果化を図ろうというわけです。
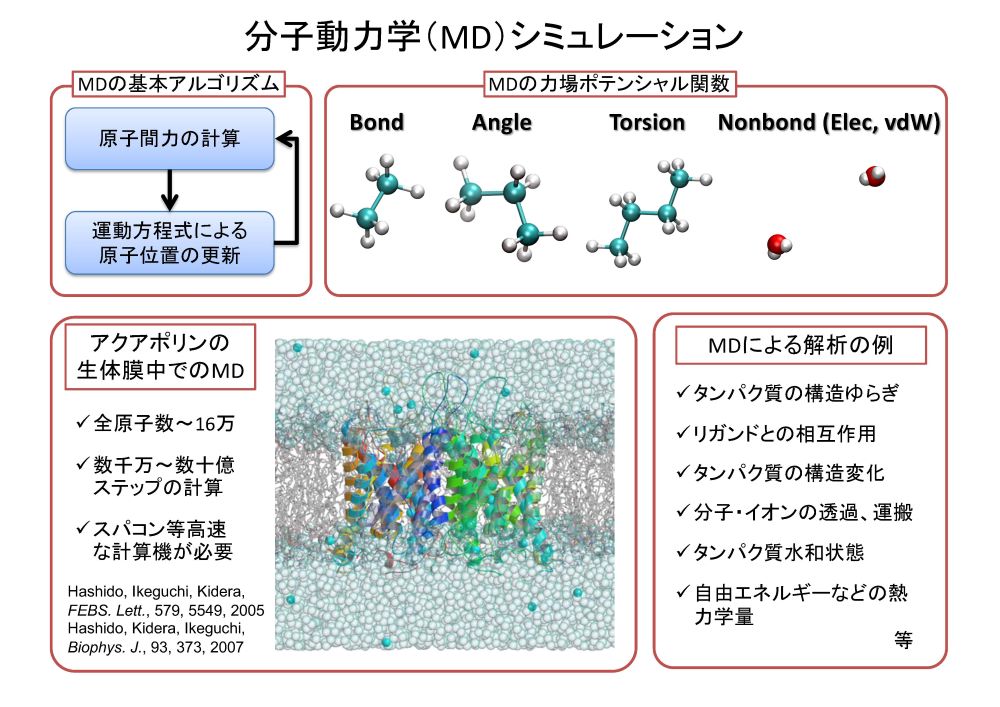
ところが、インシリコスクリーニングには、予測精度が思うように上がらないという課題がありました。タンパク質などの細胞は周囲を多くの水分子に囲まれており、タンパク質は絶えず高速で動いています。そのため、静止状態のタンパク質の立体構造と化合物との結合を考えるだけでは不十分なのです。そこで、注目されているのが、タンパク質の動きをシミュレーションできる分子動力学シミュレーション(MD法)です(図1)。池口ユニットリーダーはこのMD法を使ってタンパク質の動きや化合物との結合の様子を再現する研究に、長年にわたり取り組んできました。
MD法は、原子と原子の間に働く力を計算し、運動方程式を使って原子位置を更新することを繰り返すことで、タンパク質を構成する原子の動きを再現できるのが特徴です。ピコ(1兆分の1)~マイクロ(100万分の1)秒の時間変化を原子レベルの解像度で再現することができます。
とはいえ、MD法では、タンパク質や周囲環境を構成する数十万個もの原子間に働く力をすべて計算し更新するという操作を、数億回繰り返さなければなりません。そのため、計算量が膨大になり、高精度で予測するためには「富岳」のようなスーパーコンピュータが欠かせません。したがって、「富岳」の成果創出加速プログラム※1においてもMD法は主要なアプリケーションの1つと位置付けられています。
加えて、「富岳」の成果創出加速プログラムでは、シミュレーションとAIの融合にも注力しています。AIを活用することでビッグデータから重要な情報を抽出したり、さまざまな予測をしたりできるようになることが期待されます。シミュレーションの際、従来は人が行っていた部分をAIに担わせることで、大幅な効率化を図り研究を加速させることが可能となります。
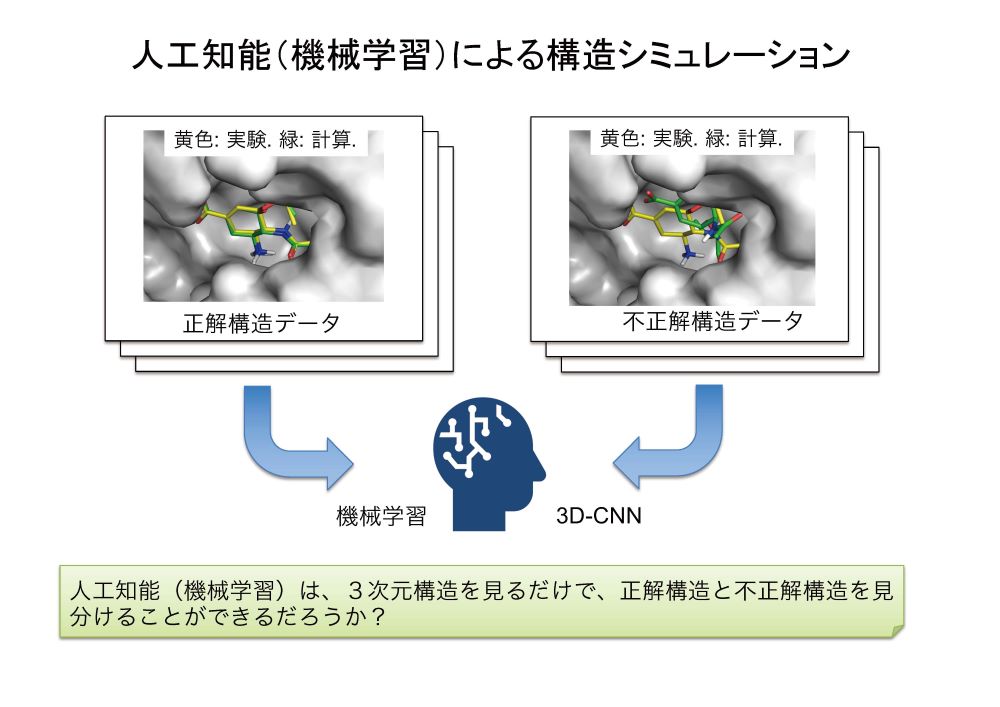
AIに関するキーテクノロジーとしては、3D-CNN(3次元畳み込みニューラルネットワーク)が挙げられます。CNNは非常にポピュラーな深層学習の手法で、これがAIの発展に大きく寄与してきました。CNN を使うことで画像認識の性能が大幅に向上します。
池口ユニットリーダーは、MIHでのプログラムにおいて、CNNの3次元版である3D-CNNをタンパク質の立体構造に適用することで、タンパク質の立体構造の精度を検証したり、より強固に結合する化合物の予測の性能向上を図ってきました(図2)。
現在、池口研究室では、MIHにおける成果を踏まえ、「富岳」の成果創出加速プログラムにおける次世代IT創薬に取り組んでいます。
- 1 成果創出加速プログラム:
「富岳」を用いた成果を早期に創出することを目的として文部科学省が設置したプログラム。(1)人類の普遍的課題への挑戦と未来開拓、(2)国民の生命・財産を守る取組の強化、(3)産業競争力の強化、(4)研究基盤の4領域について課題の選定が行われている。詳細は「富岳」成果創出加速プログラム(HPCI広報サイト「富岳百景」)
 を参照。
を参照。
次世代IT創薬におけるさまざまな取り組み
池口研究室では、MD法によるシミュレーション結果のデータをAIに学習させることで、AIの予測精度を高める取り組みを行っています。
また、MD法による計算結果は時系列の数値の並びとして出てきますので、重要ポイントを見つけ出すためにはこれまで熟練した技術が必要でした。それに対し、池口研究室では、AIを使って重要ポイントを見つけ出す取り組みも進めています。
さらに、従来はシミュレーションを実行する前に人が行っていた前提条件や仮説をAIに担わせることで、たとえば、より強いタンパク質と化合物との結合構造はどのようなものなのかなど、これまで人が気付かなかったような発見があることが期待されています。
加えて、現在、池口研究室で特に注力しているのが、疾病関連タンパク質の立体構造変化です。例えば、がん細胞では遺伝子の変異がよく起こります。その遺伝子変異が起こることによって、どのようなメカニズムでタンパク質の立体構造が変化し、がん細胞になるのかを、MD法によるシミュレーションで解明することができれば、がん細胞の発生を抑えたり、予防する方法が見つかるかもしれません。
また、従来の医薬品の多くは低分子化合物ですが、今後は、低分子医薬品だけでなく、抗体医薬や核酸医薬、細胞医薬、再生医療など治療方法の多様化が進んでいきます。新たな治療方法は「新モダリティ」と呼ばれています。
新モダリティにおいて、特に注目されているものに中分子医薬品があります。中分子医薬品は文字通り、低分子化合物と高分子化合物の中間に位置する化合物です。
低分子化合物が標的にできるタンパク質は、凹みがあり、その凹みに入り込むことができるものに限られます。しかし、低分子化合物では、高分子であるタンパク質同士の相互作用を阻害することはできません。そこで近年、抗体医薬などの高分子医薬が注目されているのですが、高分子医薬の場合、分子量が大きいため、細胞内に入ることができません。つまり、タンパク質同士の相互作用の阻害には有効なものの、細胞内のタンパク質の働きを阻害することはできないのです。それに対し、タンパク質同士の相互作用の阻害にも有効で、細胞内にも入り込むことができる中分子化合物への注目度が高まっているのです。
すでに上市されている中分子医薬品は自然界において発見されたものであり、ある菌が分泌した中分子化合物です。現在、免疫抑制剤として使われていますが、どうやって細胞内に入ることができるのかなどの詳細なメカニズムはわかっていません。そこで、池口研究室では、今後、「富岳」を使い中分子化合物がどうやって細胞膜を透過するのかをシミュレーションにより予測しようと考えています。それによりメカニズムの解明が期待されます。
関連リンク
(2021年10月1日)