創薬に計算科学を徹底利用

ゲノム科学研究所 所長
近年、画期的な新薬が生まれにくくなったといわれます。その背景には、これまでの創薬手法では薬をつくりにくい病気が対象として残り、一方で新薬の開発費が巨額化していることがあります。そこで、シミュレーションを利用して開発効率を高めようと、さまざまな研究が行われています。中でも、製薬メーカーとしていち早く「京」を積極的に利用しているのが大日本住友製薬です。同社では「京」をどのように使っているのでしょうか?野口さんに聞きました。
複雑な創薬プロセスが新薬開発の障害に
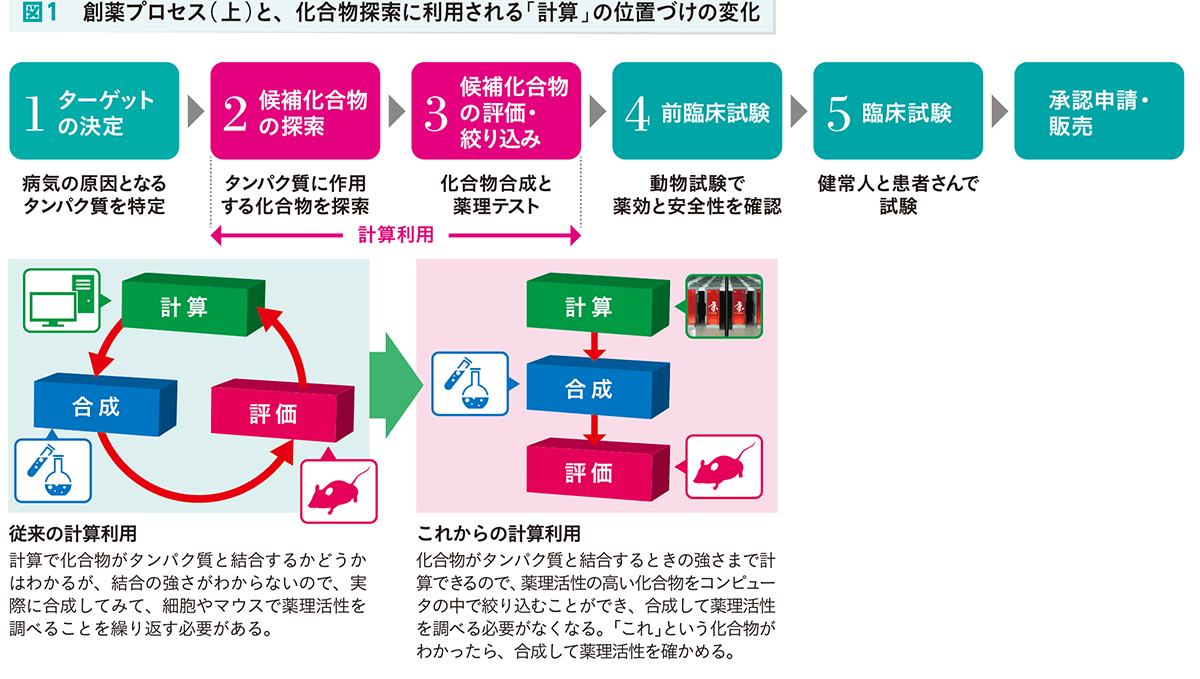
薬の開発は、病気を引き起こす分子(おもにタンパク質)を突き止めることから始まります(図1上)。このターゲット分子に結合して、悪い働きを抑える化合物が薬の候補となります。 しかし、候補化合物を見つけ、絞り込むにはたくさんの実験が必要です。さらに候補が絞り込まれたあとには、動物で薬効と安全性を確かめる前臨床試験、ヒトでの臨床試験も行わなければなりません。
1 ターゲットの決定 病気の原因となるタンパク質を特定
2 候補化合物の探索 タンパク質に作用する化合物を探索
3 候補化合物の評価・絞り込み 化合物合成と薬理テスト
4 前臨床試験 動物試験で薬効と安全性を確認
5 臨床試験 常人と患者さんで試験
→承認申請・販売
従来の計算利用
計算で化合物がタンパク質と結合するかどうかはわかるが、結合の強さがわからないので、実際に合成してみて、細胞やマウスで薬理活性を調べることを繰り返す必要がある。
これからの計算利用
化合物がタンパク質と結合するときの強さまで計算できるので、薬理活性の高い化合物をコンピュータの中で絞り込むことができ、合成して薬理活性を調べる必要がなくなる。「これ」という化合物が わかったら、合成して薬理活性を確かめる。

この複雑なプロセスが製薬業界には重荷となっています。「新薬の開発には1000億円もの投資が必要です。 しかも、研究・開発に着手した中で、成功するものは数十分の1から100分の1 とわずかなため、投資に見合う成果を出すことがどんどん難しくなってきています」と、野口さんは説明します。
「この状況を打破するには、『薬を生み出す力』を高めなければなりません。そのための取り組みの1つとして、私は、コンピュータを使った創薬が非常に有効だと考えています」と野口さん。 その言葉通り、「京」の共用が始まった2012年9月から、大日本住友製薬は2件の課題について「京」で計算を行っています※1。
- 「京」の計算資源のうち約5%が産業利用枠となっており、公募によって利用されている。産業利用の選定課題は、成果を公開する無償利用と非公開の有償利用を合わせて25件。
候補化合物の探索に「京」での計算を活かす
「1件は有償利用で成果は非公開です。ですから、どんな薬を開発しているかはお話しできないのですが、 ターゲットとなるタンパク質と候補化合物の結合の強さを『分子動力学シミュレーション』(「スパコンのことば」参照)という方法で計算しています。 結合が強ければ薬理活性(薬としての働き)も強いと期待されるので、結合の強さの計算によって候補化合物を効率よく見つけることができます」と、野口さんは「京」の利用内容を説明します。
これまでも、タンパク質と候補化合物が結合するかどうかの計算は行われてきました(図2左)。コンピュータの中にタンパク質の立体的な形を再現しておき、 そのポケット(鍵穴)に候補化合物(鍵)がぴったり入るかどうかを調べるのです。ただし、この方法では、タンパク質は形が固定されたまま、周囲に何もない仮想的な環境に置かれており、 体内ではタンパク質の周りを取り囲んでいる水分子や脂質分子(細胞膜の構成成分)が考えに入っていません。このため、タンパク質と候補化合物が結合するかどうかはわかるのですが、 結合の強さまではわかりませんでした。
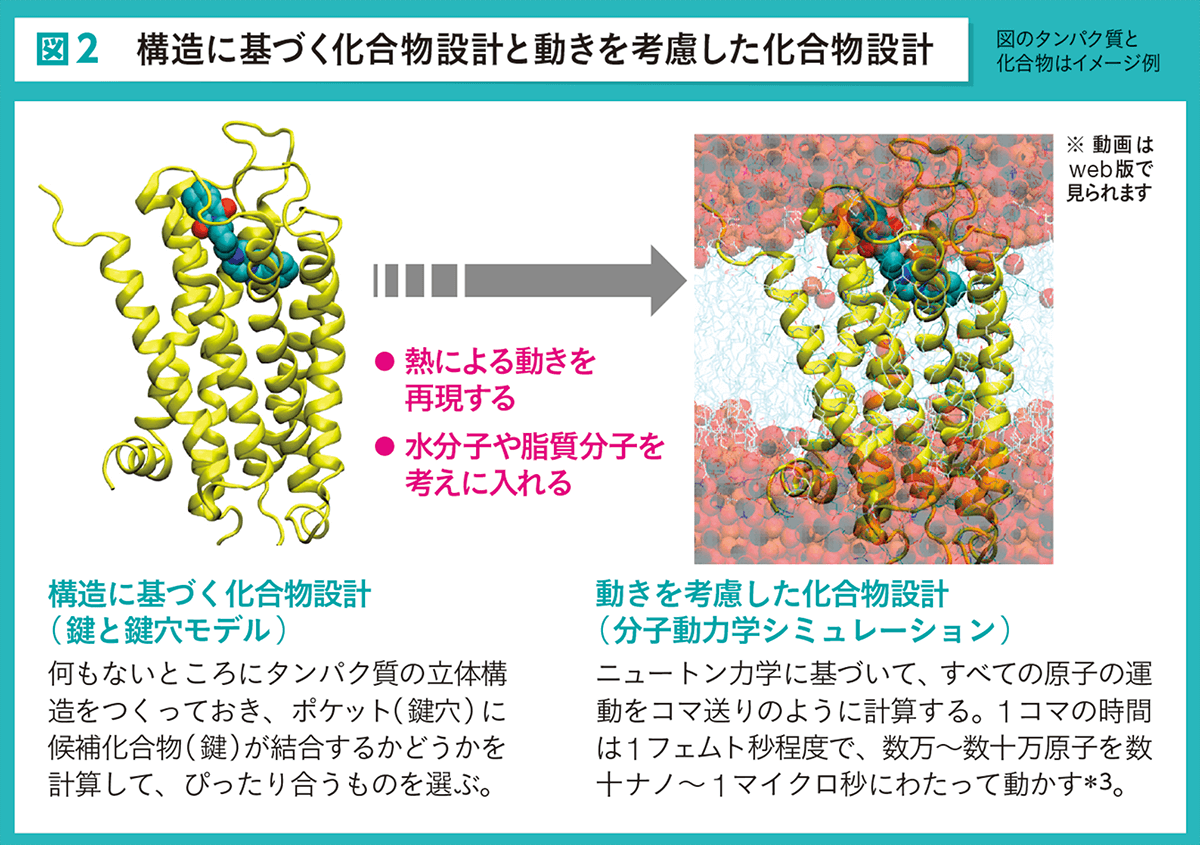
何もないところにタンパク質の立体構造をつくっておき、ポケット(鍵穴)に 候補化合物(鍵)が結合するかどうかを計算して、ぴったり合うものを選ぶ。
動きを考慮した化合物設計(分子動力学シミュレーション)
ニュートン力学に基づいて、すべての原子の運動をコマ送りのように計算する。1コマの時間は1フェムト秒※3程度で、数万~数十万原子を数十ナノ~ 1マイクロ秒※3にわたって動かす。

- マイクロは10の−6乗、ナノは−9乗、フェムトは-15乗。
これに対し、分子動力学シミュレーションを使うと、生体内と同じ環境で、タンパク質が刻々と形を変えながら候補化合物と結合するようすを再現できます(図2右)。 そして、このシミュレーションから、結合の強さを精度よく求めることができるのです。このシミュレーションは計算量が膨大で、従来のコンピュータでは実行不可能なため、同社では早くから、 独自にソフトウェアを開発している名古屋大学の岡崎進教授※2との共同研究を行い、「京」での計算をめざしてきました。
- 「分子動力学シミュレーションソフトModylasを開発。 HPCI戦略プログラム「分野2 新物質・エネルギー創成」のメンバーでもある。
そこまで精力的に取り組む理由を野口さんはこう説明します。「これまでの計算では結合の強さがわからなかったので、候補化合物を実際に合成し、薬理活性を測ってみては、 候補化合物の構造を手直しするというプロセスを繰り返していました(図1下左)。しかし、結合の強さが計算によって精度よくわかれば、この繰り返しは不要になり、 『これ』という化合物を合成するだけですむようになります(図1下右)。『京』での計算は、すでに当社の創薬プロセスに組み込まれているのです」。
効果も副作用もシミュレーションで予測
もう1件は無償利用で、これまでに得られた成果はすでに公開されています。こちらは、候補化合物の探索から一歩進めて、化合物による作用の仕方の違いや、副作用の可能性までを、 シミュレーションで明らかにすることをめざしています。
この課題では、アドレナリン受容体というタンパク質をモデルとしています (図3)。この受容体は細胞の表面にあって、ポケットに化合物が入ると構造が変わり、細胞の中に複数のシグナルを伝える働きをします。 しかし、化合物の種類によって、ポケットに入ったときの受容体の構造の変化の仕方は異なり、 ある1つのシグナルだけを伝えるものもあります。そこで、効果につながるシグナルだけを伝え、副作用につながるシグナルを伝えない、そんな化合物を計算で見つけようというのが、このプロジェクトです。
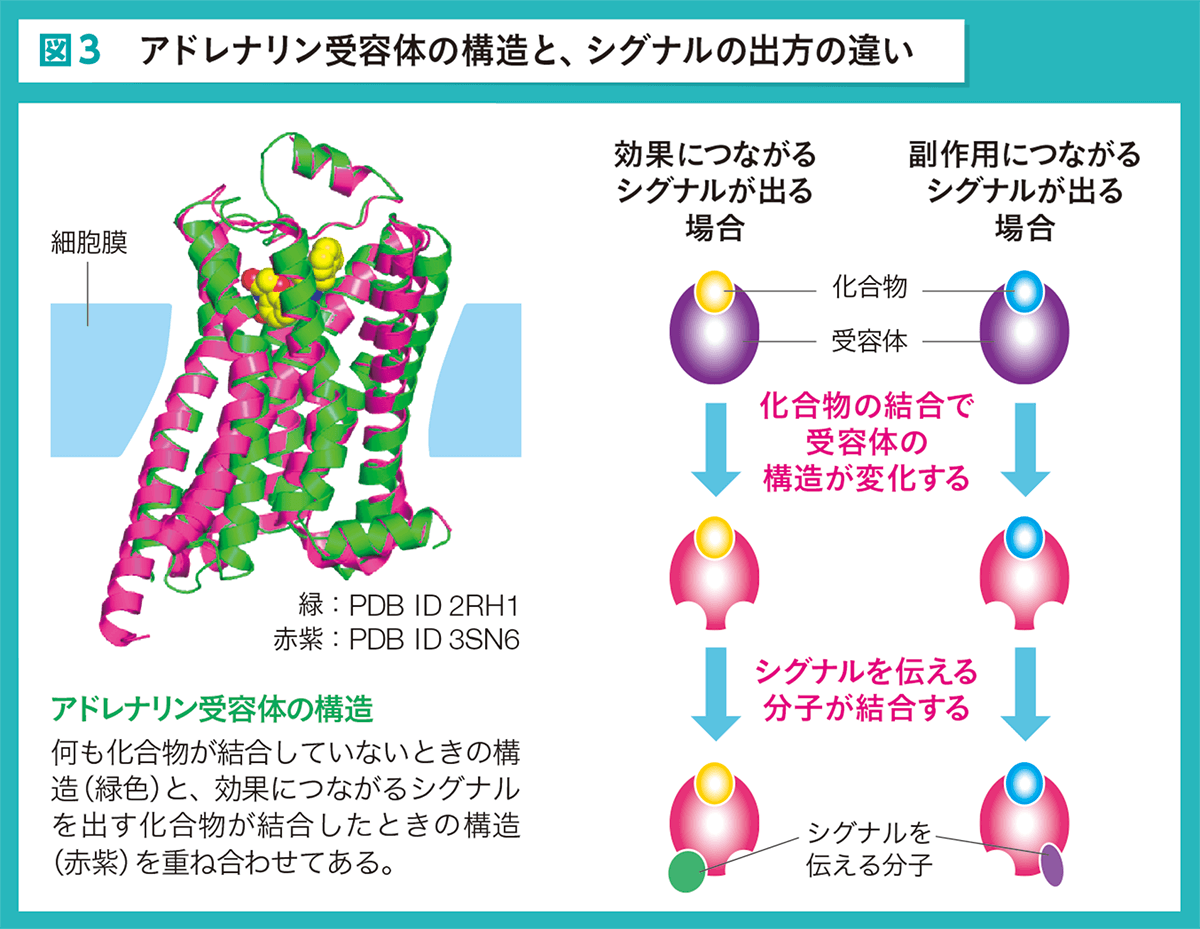
何も化合物が結合していないときの構造(緑色)と、効果につながるシグナルを出す化合物が結合したときの構造(赤紫)を重ね合わせてある。

「これまでは、何十万、何百万という化合物の作用を実際に確認して、こうした化合物を探していました。しかし、化合物が結合したあと、受容体の構造がどう変わるかをシミュレーションすれば、 実験をしなくても、このような違いを予測でき、目的のシグナルだけを伝える化合物を論理的に選び出せるのです」と、野口さんは力強く語ります。 このシミュレーションでは、数マイクロ秒※3にわたってタンパク質の動きを追いかけます。結合の強さをみるときは数十ナノ秒※3ですから、その数百倍も長い時間です。
- マイクロは10の−6乗、ナノは−9乗、フェムトは-15乗。
徹底的にコンピュータを使う創薬へ
2件の課題からは、これまで実験や経験に支えられてきた薬の候補化合物の探索を、シミュレーションで行える時代がいよいよやってきたことがわかります。 しかし、野口さんはもっと大きな志を抱いています。「京」で予測した薬理活性のデータと、病気の患者さんの臨床データやゲノムデータ、人工多能性幹細胞(iPS細胞)からつくった病気の細胞のデータなどを、 「細胞」という場で統合して、ある化合物を与えたときに細胞がどのような反応を示すかを、すべてコンピュータの中で予測したいというのです。
「これは夢ではなく、大まかなものは5年後、実用レベルで10年後には実現できると考えています」と野口さんは自信を見せます。 計算科学とさまざまなデータに支えられる創薬。製薬業界はこれから大きな転換点に向かうことになりそうです。
野口さんはこんな人

に収録されています。
